Gyors ajánlatkérés
Jó tudni
Tovább »
Kellékek
Akkumulátorokról
Általános
Ebben a részben leírjuk az elektromos targoncáknál leggyakrabban alkalmazott akkumulátor típus, a savas ólomakkumulátor általános jellemzőit. Kérjük vegye figyelembe, hogy az akkumulátor karbantartás és javítás speciális képzést és felszerelést igényel.

A savas ólomakkumulátor a kémiai energiát elektromos energiává alakítja. Az akkumulátorban lejátszódó kémiai folyamatok biztosítják az elektromosságot. Ha a kémiai reakció lezajlott, és tovább már nem szolgáltatja a szükséges áramot, az akkumulátor lemerült. Egy fordított kémiai reakciónak kell bekövetkeznie ahhoz, hogy az akkumulátor újra használható legyen. Az itt leírt akkumulátorok egy külső forrásból újratölthetőek elektromos feszültséggel és árammal. Az ólom-savas vegyi anyagok tárolják az elektromos energiát, amíg azt nem használjuk fel valamilyen elektromos eszköz működtetésére.
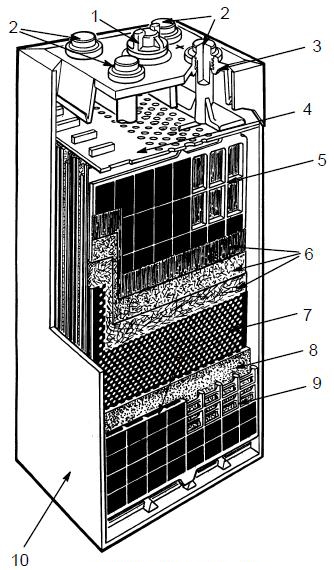
- SZELLŐZŐ- ÉS TÖLTŐSAPKA
- ÉRINTKEZŐ
- ÉRINTKEZŐ SZIGETELÉS
- VÉDŐ LEMEZ (PAJZS)
- POZITÍV LEMEZ
- ELVÁLASZTÓ
- RÖGZÍTŐ
- SZÉTVÁLASZTÓ
- NEGATÍV LEMEZ
- AKKUMULÁTORCELLA BURKOLAT
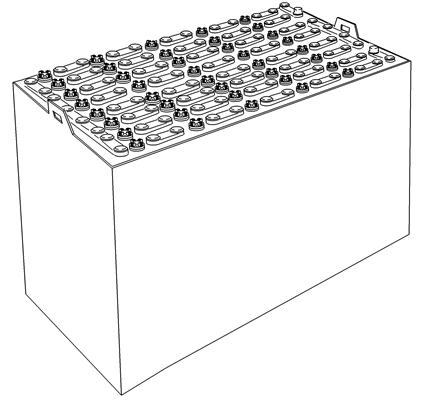
Ábra 2. Savas ólomakkumulátor tárolóedényben
A targoncák menetakkumulátora több, celláknak nevezett kisebb ólomakkumulátorból áll. Minden cella rendelkezik pozitív és negatív lemezekkel, és a lemezek közötti szigetelőlapokkal. Minden lemez elektrolit oldatban van. A cellák sorba vannak kötve, így feszültségük összeadódik.
Fajsúly
Az elektrolit erősségét a fajsúly jellemzi. Például egy kénsav oldatnak a fajsúlya 1,835. A víz fajsúlya 1,000. Az elektrolit 27% sav és 73% víz, fajsúlya pedig 1,275.
Kémiai reakció egy cellában
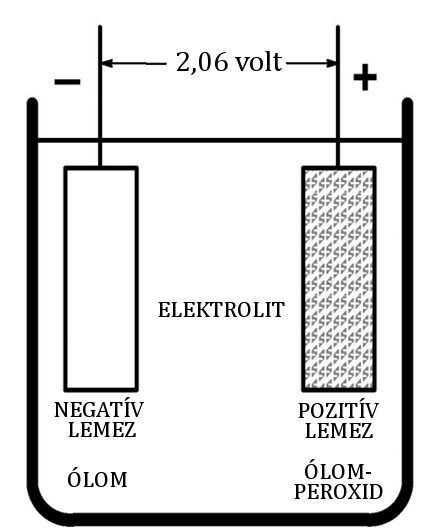
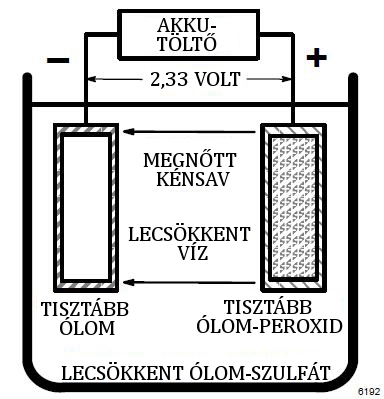 Ábra 3 : Teljesen feltöltött cella.
Ábra 3 : Teljesen feltöltött cella.
Egy teljesen feltöltődött cellában, az elektrolit fajsúlya 1,270 és 1,130 között van. Az akkumulátor fajsúlya ne legyen 1,130 alatt, mert az maradandóan károsodhat.
A cella feszültséget hoz létre (potenciálkülönbség) amikor két különböző típusú fém van az elektrolitban. Az ólom akkumulátor cellájában lévő pozitív lemez anyaga ólom-peroxid (PbO3), a negatív lemezé pedig ólom (Pb). Megközelítőleg 2 V feszültség jön létre cellánként. A potenciálkülönbség nem függ a cella méretétől.
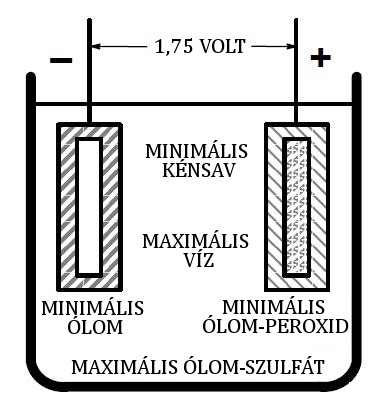
Ábra 4. Merülő cella
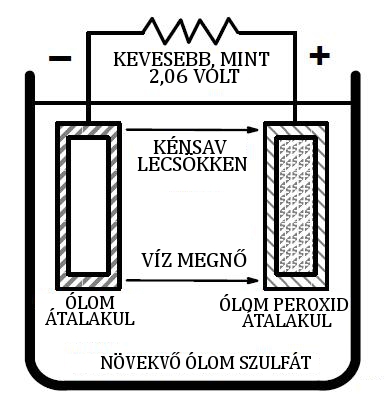
A cella kisütése során az ólom-peroxid és ólom keveredik a kénsavval, hogy ólom-szulfátot hozzon létre (PbSO4) mindkét lemezen (lásd ÁBRA 4.). Ez a folyamat csökkenti a feszültséget a cellában. Amikor a kénsavat elvesszük az elektrolitból, az elektrolit fajsúlya csökken (lásd ÁBRA 5.). A lemerült cella potenciálkülönbsége megközelítőleg 1,75 volt.
Ábra 5. Lemerült cella.
Amikor egyenáramot vezetünk egy lemerült cellába, az ólom-szulfát kénsavra és ólomra bomlik szét. Az ólom a pozitív lemezen ólomként, a negatív lemezen pedig ólom-peroxidként rakódik le (lásd ÁBRA 6.). Az elektrolitban növekszik a kénsav koncentrációja és ezzel együtt a fajsúlya is megnő. Egy teljesen feltöltött cellában a pozitív lemez ismét tiszta ólom-peroxidot tartalmaz, a negatív pedig ólmot.
Ábra 6. Cella töltés alatt
Akkumulátorok kapacitása
A targonca akkumulátorok kapacitását amper-órában határozzák meg, általában öt órás értéket (C5) megadva.
Egy C5 (ötórás kapacitás)= 500 amper–órás akkumulátor 100 ampert tud előállítani óránként, 5 órán keresztül. Ugyanez az akkumulátor nem tud 250 ampert leadni két óra alatt. Az akkumulátor által létrehozott hő károsítaná önmagát.
Egy cella potenciálkülönbsége nem változtatható meg. Az amper-óra érték növelhető a cellában lévő lemezek mennyiségének a növelésével, vagy a meglévő cellák nagyobbra cserélésével.